来源:企业发布、CACLP体外诊断资讯
近日,万孚生物美国全资子公司Wondfo USA Co.,Ltd收到美国食品药品监督管理局(FDA)通知,美国子公司的新型冠状病毒、甲型流感病毒及乙型流感病毒三联家庭检测试剂盒WELLlife COVID-19 / Influenza A&B Home Test获得美国食品药品监督管理局(FDA)的应急使用授权(EUA240011)。

5月8日,天津九安医疗电子股份有限公司美国子公司 iHealth Labs Inc.的新型冠状病毒、甲型流感病毒及乙型流感病毒三联家庭检测(OTC)试剂盒获得美国食品药品监督管理局(FDA)应急使用授权(EUA230053)。获授权后该产品可在美国和认可美国 EUA 的国家/地区销售。
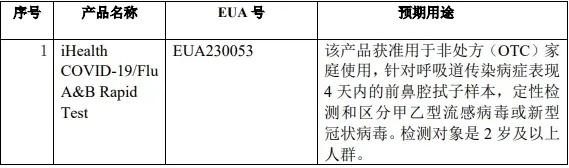
该产品可作为区分新型冠状病毒和甲、乙流病毒的检测工具,方便个人和家庭实施针对性治疗。三联检 OTC 试剂盒产品可由个人自行采集前鼻腔拭子样本进行操作,15 分钟出结果。 需求者购买无需处方,通过美国的电商、药店、商超等渠道进行销售,预计未来可能为公司带来相关销售收入。此次检测产品通过FDA EUA是公司核心战略相关业务的进一步拓展,丰富了公司 IVD 领域的产品线。
---The End---
鸿盟医学
医疗器械全球注册咨询、医疗器械临床试验、医疗器械质量管理体系(ISO13485/GMP/QSR)、医疗器械可用性研究、
医疗器械法规培训为一体的专业技术咨询服务机构
微信号:hom_medical、18018710006 联系电话:18018716006
上一篇:
最新!国家重大部署!利好医疗市场 下一篇: 国家药监局关于实施《体外诊断试剂分类目录》有关事项的通告
 鸿盟标准技术(深圳有限公司)
鸿盟标准技术(深圳有限公司)