一、产品信息
试验组:腕式血压计(成人型,电子血压计,非连续监测、非动态监测)
对照组:普通水银血压计
二、试验目的和内容
通过临床试验,评价研制的腕式血压计血压监测功能的临床有效性和安全性。
三、试验方法
3.1通过与听诊法测量的血压(收缩压、舒张压)相对比,评价腕式血压计测量血压(收缩压、舒张压)和对比血压(收缩压、舒张压)的有效性。
3.2通过器械缺陷和不良事件记录,评价腕式血压计临床应用的安全性。
3.3 操作方法:同臂顺序法
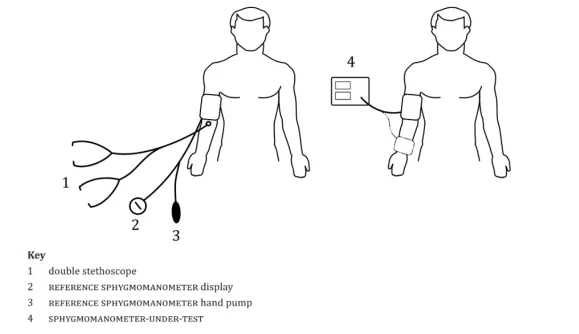
⑴选择两名具有丰富血压听诊经验的研究者作为听诊者,并在临床试验开展前对其进行血压听诊方法培训和训练。
⑵选择需要进行无创血压测量的患者或健康志愿者,本人或其法定监护人同意参加本临床试验,并自愿签署知情同意书。
⑶使用水银血压计听诊法测量血压作为入组血压,根据受试者的入选和排除标准和血压分区段临床试验例数判断是否符合纳入临床试验;
⑷。
⑸。
⑹。
⑺。
⑻。
⑼。
⑽。
⑾。
⑿。
⒀。
四、试验人群(入组、排除标准)
(1)入选标准
1)自愿参加并签署知情同意书;
2)年龄12~80岁,性别不限;
3);
4);
5)。
(2)排除标准
1)存在动脉炎、动脉阻塞性疾病患者;
2)测量部位有伤口或有静脉输血输液,导致无法测量者;
3)测量一侧做过乳房切除术者;
4);
5);
6);
7);
8)。
(3)停止试验/试验治疗的标准和程序
1)试验中发生严重安全性问题(如出现严重不良反应或者出现严重并发症或病情迅速恶化者),应及时终止;
2)试验中发现研究器械效果太差,甚至无效,不具有临床价值,继续进行下去会延误受试者的有效治疗;
3);
4);
如果中途停止试验治疗,必须在病例报告表中的适当栏目申明其主要原因,并尽可能完整地报告所观察到的现象,以及在受试者退出研究时,对其进行全面地评估,包括治疗后的常规检查。
五、样本量
至少85例,考虑筛选等因素,放大1.2倍,需要102例。
样本分布如下:
a)至少10%受试者的收缩压应≦100mmHg(13.33kPa);
b)至少5%受试者的收缩压应≧160mmHg(21.33kPa);
c)至少20%受试者的收缩压应≧140mmHg(18.66kPa);
d);
e);
f);
注:以上血压值均为参考设备读出。
六、试验机构
单中心(可以是GCP基地,也可以不是,心血管病科为主)
七、总体设计
本临床试验采用单中心、开放设计、配对设计的试验设计。
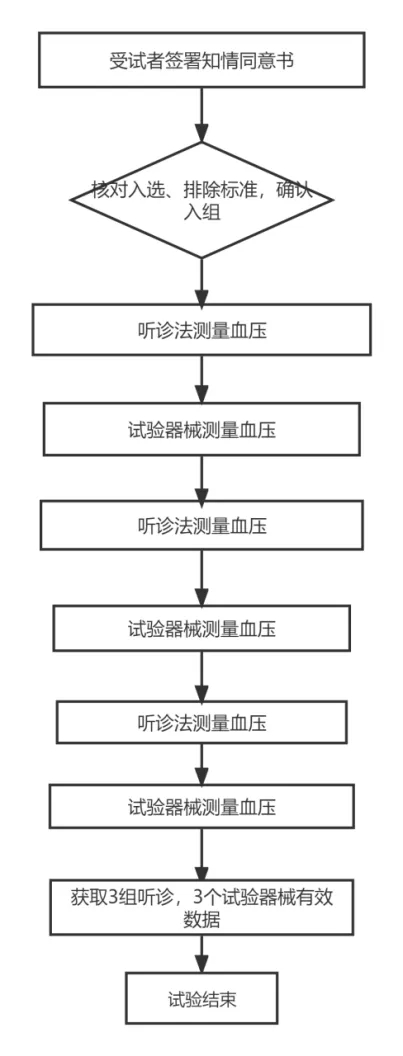
八、整体试验流程
合作企业:
爱奥乐医疗器械(深圳)有限公司,深圳康恒医疗集团有限公司,深圳瑞光康泰科技有限公司,深圳市耐菲尔医疗器械科技有限公司,乐普医疗,威高,长坤,可孚,深圳市源动创新,捷美瑞,汉王











鸿盟医学
医疗器械全球注册咨询、医疗器械临床试验、医疗器械质量管理体系(ISO13485/GMP/QSR)、医疗器械可用性研究、
医疗器械法规培训众多的专业技术服务咨询机构
微信号:hom_medical、18018710006 联系电话:18018716006
 鸿盟标准技术(深圳有限公司)
鸿盟标准技术(深圳有限公司)